Произвольные движения
В осознанном контроле за произвольными движениями принимает участие кора лобных долей головного мозга, откуда нервные импульсы передаются в конечности. Роль посредников в передаче импульсов между нейронами и синапсами играют химические нейротрансмиттеры, важнейшим из которых является ацетилхолин. В акте произвольного движения участвует и Пирамидная система. Однако важным для целостного процесса движения является контроль не только за произвольными, но и за непроизвольными движениями. Эту функцию выполняет Экстрапирамидная система, обеспечивающая плавность движений и возможность прервать начатое действие. Эта система объединяет структуры - базальные ганглии, располагающиеся за пределами продолговатого мозга (отсюда термин "экстрапирамидная система". Нейротрансмиттер, обеспечивающий бессознательный контроль за движениями, получил название "дофамин". В основе Болезни Паркинсона лежит дегенерация дофаминергических нейронов - нейронов, вырабатывающих и накапливающих дофамин.
Нарушение функции дофаминергических нейронов приводит к дисбалансу тормозных (дофаминовых) и возбуждающих (ацетилхолиновых) нейротрансмиттеров, что клинически проявляется симптомами Болезни Паркинсона. Больше всего страдают клетки черной субстанции, которые контролируют произвольные движения и настроение. Вначале последствия гибели нейронов в этой области компенсируют другие нейроны, но когда доля утраченных клеток достигает 50-80%, незатронутые области головного мозга не справляются с перегрузкой. С этого момента части головного мозга, тоже вовлеченные в регуляцию двигательной активности, в том числе остальная часть базального ганглия, таламус и кора головного мозга, перестают работать согласованно, и движения становятся неконтролируемыми
Лечение Болезни Паркинсона, целью которого является восстановление нарушенного баланса нейротрансмиттеров, может быть направлено либо на повышение уровня дофамина в мозге, либо на снижение уровня ацетилхолина.
Базальные ганглии (рис.1) объединяют следующие структуры: хвостатое ядро, скорлупу (вместе - полосатое тело), бледный шар и черную субстанцию Базальные ганглии получают импульсацию от лобной коры, ответственной за контроль произвольных движений, и опосредуют обратный непроизвольный контроль за движениями через премоторную кору и таламус.
Болезнь Паркинсона возникает вследствие дегенерации дофаминергических нейронов черной субстанции.
Дофамин вырабатывается и накапливается в пузырьках (везикулах) пресинаптического нейрона и затем под воздействием нервного импульса высвобождается в синаптическую щель. В синаптической щели он связывается с дофаминовыми рецепторами, располагающимися в постсинаптической мембране нейрона, в результате чего обеспечивается дальнейшее прохождение нервного импульса через постсинаптический нейрон.

Роль "плохих белков"
У многих больных, умерших от паркинсонизма, при вскрытии в черной субстанции обнаруживаются белковые скопления (они называются тельцами Леви по фамилии немецкого патологоанатома, открывшего их в 1912 г.). Аналогичные образования характерны также для болезни Альцгеймера и хореи Гентингтона. Являются ли эти кластеры причиной деструктивных изменений или, напротив, выполняют защитные функции, удерживая аномальные, токсичные для нейрона белки от распространения по всей клетке, - не совсем ясно. В любом случае большинство ученых сходятся на том, что выяснение причины кластеризации белков поможет раскрыть тайну болезни Паркинсона.
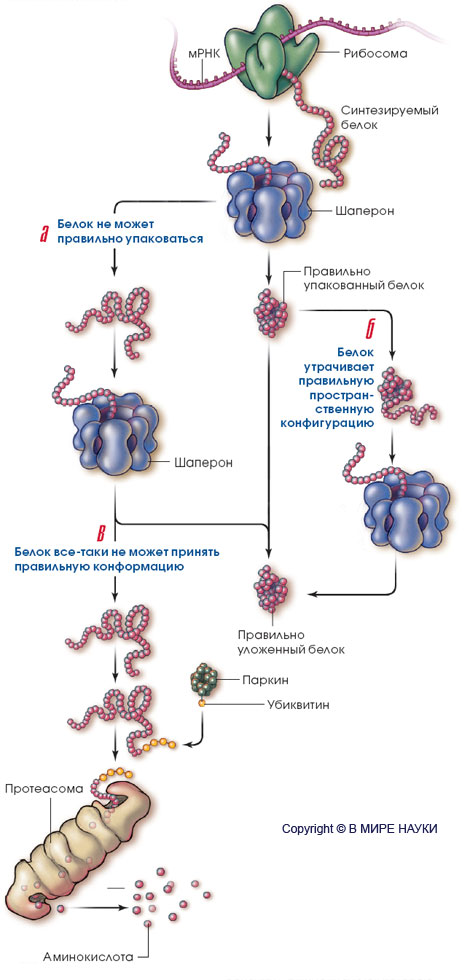
Центральное место во всей этой истории занимают два внутриклеточных процесса: пространственная упаковка белков и их элиминация. Белки синтезируются в клетке в виде полимерной цепочки из аминокислот, соединяющихся друг с другом в соответствии с инструкциями, записанными в генах. По завершении синтеза белковая молекула сворачивается в компактную трехмерную глобулу при участии особых молекул - шаперонов. Эти же молекулы вновь упаковывают белки, утратившие должную конфигурацию.
Если по тем или иным причинам шаперонная система выходит из строя, то неправильным образом уложенные белки становятся мишенью для так называемой убиквитин-протеасомной системы. Сначала к белковой молекуле с аномальной конформацией присоединяется небольшой белок убиквитин (процесс называется убиквитинилированием). Вслед за первой убиквитиновой "бусиной" присоединяется вторая - и так до тех пор, пока на конце обреченной на гибель белковой молекулы не образуется цепочка (своеобразная "черная метка"). Она служит сигналом для протеасомы ("мусорщика" нервной клетки) к расщеплению аномального белка на составляющие его аминокислоты. В 2004 г. за исследование этой системы были удостоены Нобелевской премии по химии Авраам Гершко (Avram Hershko) и Аарон Цихановер (Aaron Ciechanover) из Института "Технион" в Израиле, а также американский биохимик Ирвин Роуз (Irwin Rose) из Калифорнийского университета.
Скопление в головном мозге неправильно упакованных белков (образование телец Леви) считается "визитной карточкой" болезни Паркинсона. Однако ученые до сих пор не знают, выполняют ли эти скопления защитные функции (они концентрируют токсичные для нейронов белки, предотвращая их распространение по всем клеткам) или, напротив, служат причиной гибели нервных клеток. В любом случае ясно, что у истоков болезни находится неправильная упаковка белков.
В нормальных клетках правильную пространственную укладку белковых молекул обеспечивают сложные комплексы - "шапероны". Когда белки упаковываются ненадлежащим образом (а) или в результате каких-то воздействий утрачивают нормальную пространственную конфигурацию (б), шапероны исправляют ситуацию.
Если шаперонная система не работает, то белок остается уложенным неправильно (в) и протеасома ("чистильщик" клетки) расщепляет его, прежде чем он успевает причинить какой-либо вред. Происходит это следующим образом. Вначале белок под названием "паркин" последовательно присоединяет к неправильно уложенному белку молекулы убиквитина. Цепочка из убиквитиновых "бусин", свисающая с конца белка, подает сигнал протеасоме к действию, и та дробит белок на мелкие осколки - аминокислоты, которые клетка может использовать по своему усмотрению.
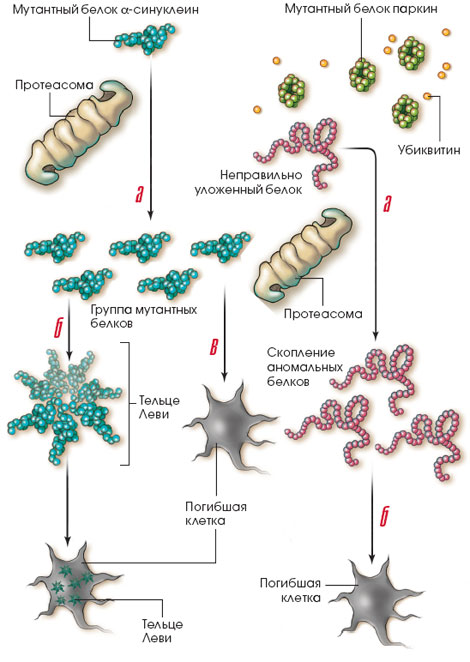
У больных паркинсонизмом протеасомная система не работает. В этом случае неправильно упакованные белки накапливаются в клетке, поскольку шапероны не успевают приводить их в норму, а протеасомы - расщеплять на части, и в конце концов нейроны погибают. К такой аномалии приводят, в частности, мутации в двух генах, один из них кодирует белок -синуклеин (слева), другой - паркин (справа).
Болезнь Паркинсона может вызвать очень редкая мутация в гене белка -синуклеина. Мутантный белок приобретает такую пространственную конфигурацию, при которой протеасома не может его расщепить (а). Аномальные белки собираются в кластеры - так называемые тельца Леви (б). Вначале эти кластеры дают клетке некоторые преимущества, и она погибает позже, чем в том случае, когда неправильно упакованные белки распределяются по всему нейрону (в).
Мутантный паркин не может присоединять убиктивин к неправильно упакованным белкам и в результате они избегают расщепления протеасомами (а). Таких белков становится в клетке все больше, они не образуют телец Леви, и клетка быстро погибает (б).
Здоровье


.jpeg)
.jpeg)
.jpeg)
.jpeg)
.jpeg)
.jpeg)
.jpeg)
